大腸ポリープとは
大腸ポリープは、直腸から盲腸までの大腸に発生するキノコ状の突起物のことを言います
この突起物である大腸ポリープは、腫瘍性のものと非腫瘍性のものに分かれていますが、通常私たちが言う大腸ポリープとは腫瘍性の「腺腫」というものを指します。
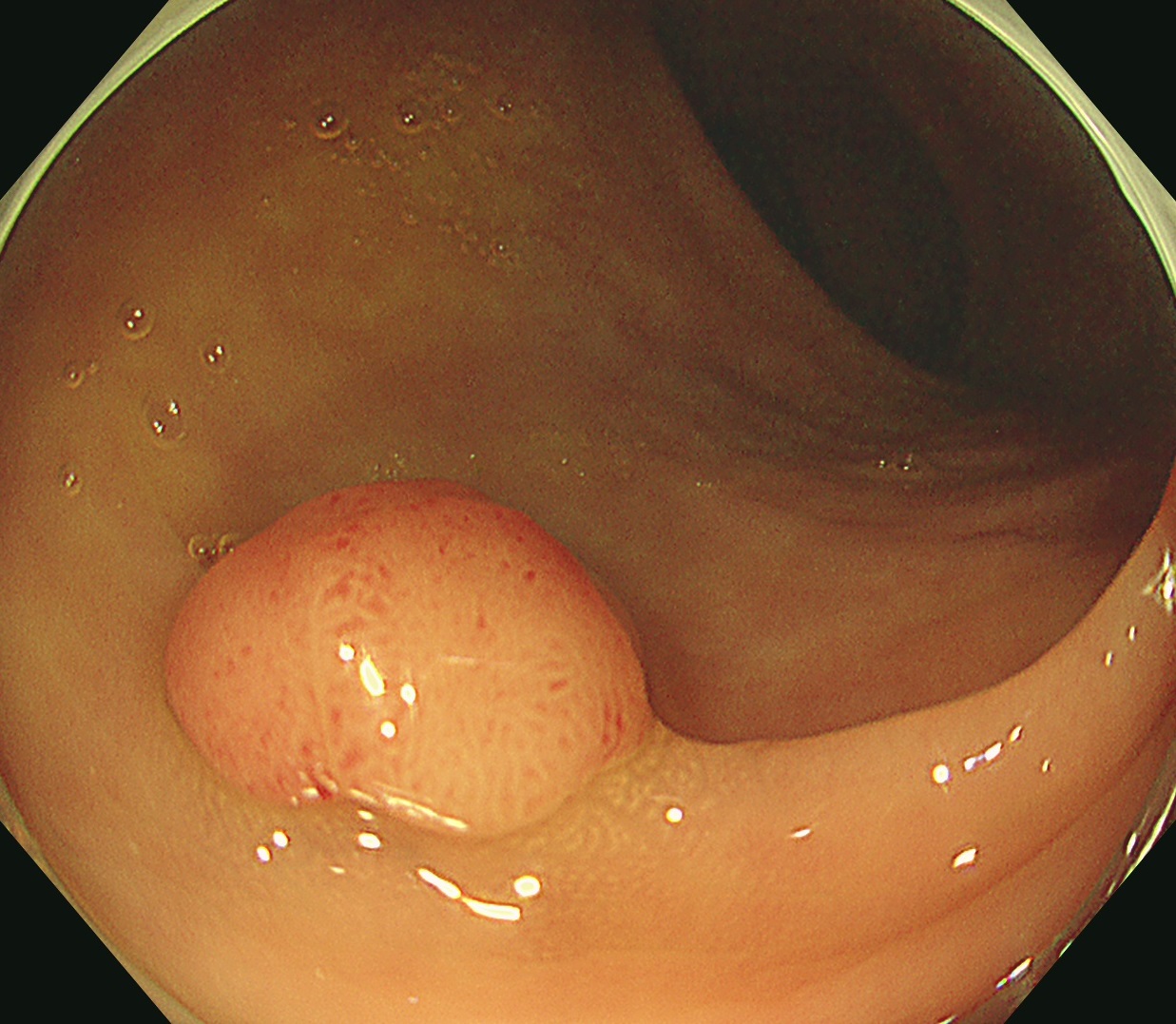
腺腫性の大腸ポリープの内視鏡像
大腸ポリープには、様々な大きさや形、大腸の様々な場所に発生します。 私たち内視鏡医はこの3つを大きな指標として検査・治療に取り組んでいます。
大腸ポリープの重要な指標
- ① 大きさ
- ② 形
- ③ 発生部位
大腸ポリープ(腺腫)は、大きさが小さいときにはほとんどが良性ですが、大きくなったり形が崩れていたりすると悪性であることがあります。 大きなポリープには、ポリープ内に一部がん細胞が混ざったりします。 また、大腸ポリープが成長して大きくなることで、がん化していくことがあります。
そのため、大腸ポリープの検査および治療に関しては非常に重要です。
大腸ポリープの種類
大腸ポリープの種類には、大きく分けると腫瘍性のものと非腫瘍性のものの2つがあります。 私たちが大腸ポリープと呼んでいるものは「腺腫」と言って、腫瘍性のものとなります。 この腺腫にも、いくつかの種類があります
腺腫の主な種類
- ① 管状腺腫
- ② 管状絨毛腺腫
- ③ 絨毛腺腫
- ④ 平坦腺腫
腺腫以外の大腸ポリープ
- 鋸歯状ポリープ
- ポリポイド腺癌
- 炎症性ポリープ
- 過誤腫性ポリープ
- 間質性ポリープ
- リンパ組織性ポリープ
- 内分泌性ポリープ
大腸ポリープはがん化するのか
結論から言うと大腸ポリープは、がん化します
大腸ポリープは、大腸腺腫を介して大腸がんへと変化すると考えられており、これをadenoma-carcinoma-sequence(多段階化説)といいます。 カタカナでいうとアデノーマ・カルチノーマ・シークエンスで、日本語だと「腺腫-がん連関」と言います。
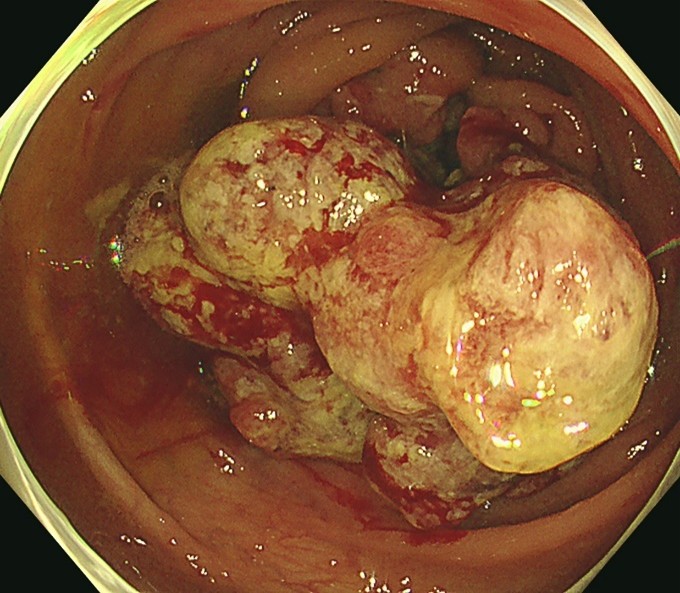
隆起状の大腸がんの内視鏡像
adenoma-carcinoma-sequenceとは
このadenoma-carcinoma-sequenceは1988年にジョンズ・ホプキンズ大学のVogelsteinが提唱したもので、大腸の正常の粘膜から腺腫となりどのようにがんへと変化していくかが仮説として説明されています。
adenoma-carcinoma-sequenceでは、上図のように正常の粘膜が下記の4つの遺伝子が変異していくことでがん化すると考えられています。
がん化に関わる主な遺伝子
- APC
- KRAS
- TP53
- DPC4/DCC
実際には、上記4つの遺伝子の他に様々な要素で大腸腺腫から大腸がんへと変貌していくのではないかと報告されています。
大腸ポリープの検査方法
大腸ポリープの検査のゴールデンスタンダードは、大腸カメラ(大腸内視鏡検査)
大腸ポリープの検査にはいくつか検査方法がありますが、基本的には大腸カメラが第一に挙げられます。大腸スコープを直接大腸内に挿入して、直接大腸粘膜を観察することで小さな大腸ポリープを見落としなく検査をすることができます。
その他の検査方法
- ① CTコロノグラフィ
- ② 注腸検査
大腸カメラがどうしてもできない場合には、上記①②が施行されることがあります。ただし検査が不十分な可能性があるため一般的には推奨されていません。また、CTコロノグラフィや注腸検査では、小さなポリープや扁平なポリープなどは検出されない可能性もあるため、大腸カメラで詳細な観察を行うことが望ましいです。
大腸カメラの費用については下記ブログ記事を参考にしてください。
大腸ポリープの診断方法
大腸ポリープの診断には、大きさと形が重要
大きさと形によるマクロ的診断
大腸ポリープの診断方法には、様々なものがありますが一番重要なのは大きさと形です。なぜかというと、大きさや形により大腸ポリープのがん化率が変化してくるからです。
大腸ポリープががん化している率のことを「担癌率(たんがんりつ)」と言います。
担癌率は大腸ポリープの大きさが30mmを超えてくると30%を超えると報告されていたり、形はポリープ状だけれどポリープの頂点に強い陥凹などがある場合には、ほとんどの場合にがんが認められると考えられています。
大きさによる担癌率
- 5mm未満 0.4~3.4%
- 5mm~10mm未満 3.4%~
- 10mm~15mm未満 12%~
- 15mm以上 20.7%~
大腸ポリープはそのサイズによって担癌率が大きくなっていくことが様々な論文によって報告されています。
形に関しては、下記のような病変の変化が腺腫とがんの鑑別の指標となると考えられています。
- 凹凸不整
- 陥凹の有無
- 病変の厚み
- 表面粘膜の粗糙
- 周囲粘膜の襞集中
などが鑑別の指標となります。
その他にも下記のようなものも診断(担癌率)の指標になると報告されています。
- 発生部位
- 色合い
- ポリープの根元に茎があるかどうか
- 出血しているかどうか
- ポリープ周辺の粘膜の状況
などがあります。私たち内視鏡医は、上記の指標を総合的に内視鏡画面を通して瞬時に判定しています。
ここまでは大腸ポリープを大きさや形でマクロ的に診断する方法でしたが、私たち内視鏡医は最新の内視鏡技術を使うことでミクロ的にも詳細に診断を行っています。
内視鏡技術によるミクロ的診断
ミクロ的な診断にはどのような技術を使用するかというと下記のようなものがあります。
- ① 拡大内視鏡検査
- ② 色素内視鏡検査
- ③ 画像強調観察検査
- ④ 超音波内視鏡検査
上記のような検査方法を使用することで、大腸ポリープの腺腫とがんの鑑別、がんであった場合の深達度(がんがどれくらい深く大腸の壁に潜っているか)を診断することができます。
① 拡大内視鏡検査
拡大内視鏡検査は、内視鏡に搭載されたズーム機能を用いて拡大された画像で大腸ポリープの表面の構造を診断する検査方法です。拡大された大腸ポリープの表面を観察するとpitという、大腸表面にある上皮腺管の開口部をみることができます。この上皮腺管の開口部や表面の微細な構造がpit pattern(ピット・パターン)と呼ばれているものです。
このpit patternの配列や構造が乱れたり、pit patternが不整であったり消失していたりする場合には、がんである可能性が高くなります。
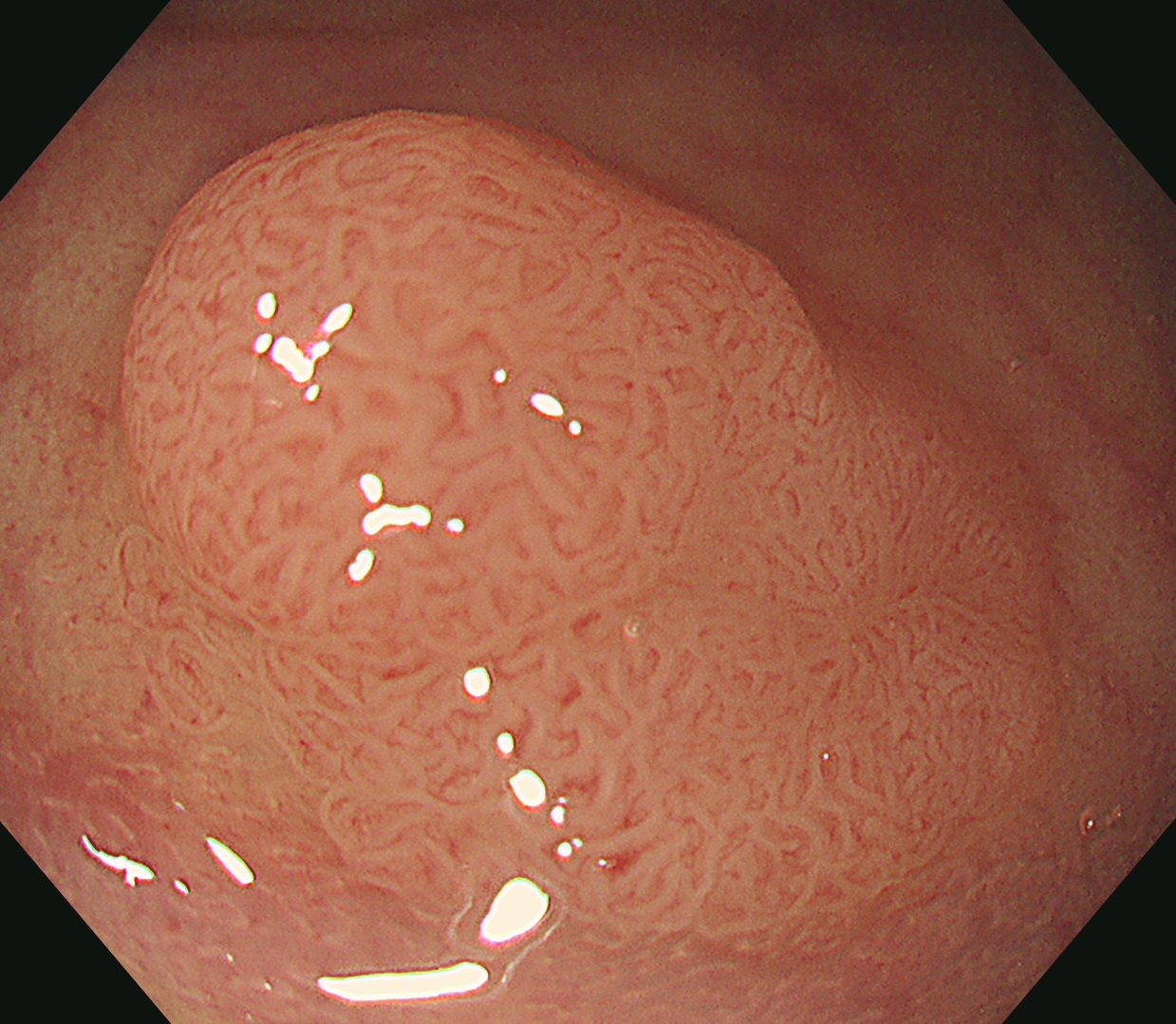
大腸ポリープの弱拡大像
② 色素内視鏡検査
色素内視鏡とは、英語でchromoendoscopy(クロモエンドスコピー)とも言い、特殊な溶液を大腸ポリープに散布して内視鏡で観察する検査方法です。色素を散布することで、大腸ポリープの表面の形や凹凸などが明瞭になることで表面正常を十分に観察することが可能となります。
色素内視鏡検査で使用される溶液には下記のようなものがあります。
- インジゴカルミン
- クリスタルバイオレット
- 酢酸
- ヨード
大腸ポリープでは、主にインジゴカルミンが使用されます。インジゴカルミンでの色素内視鏡検査による観察が不十分な場合には、クリスタルバイオレットも使用されることがあります。酢酸は主にバレット食道がんなどの診断、ヨードは食道がんの診断で使用されます。
色素内視鏡検査では、拡大内視鏡検査を併用して散布された色素により観察しやすくなった大腸ポリープの表面をズームしてより詳しく検査を行うこともあります。
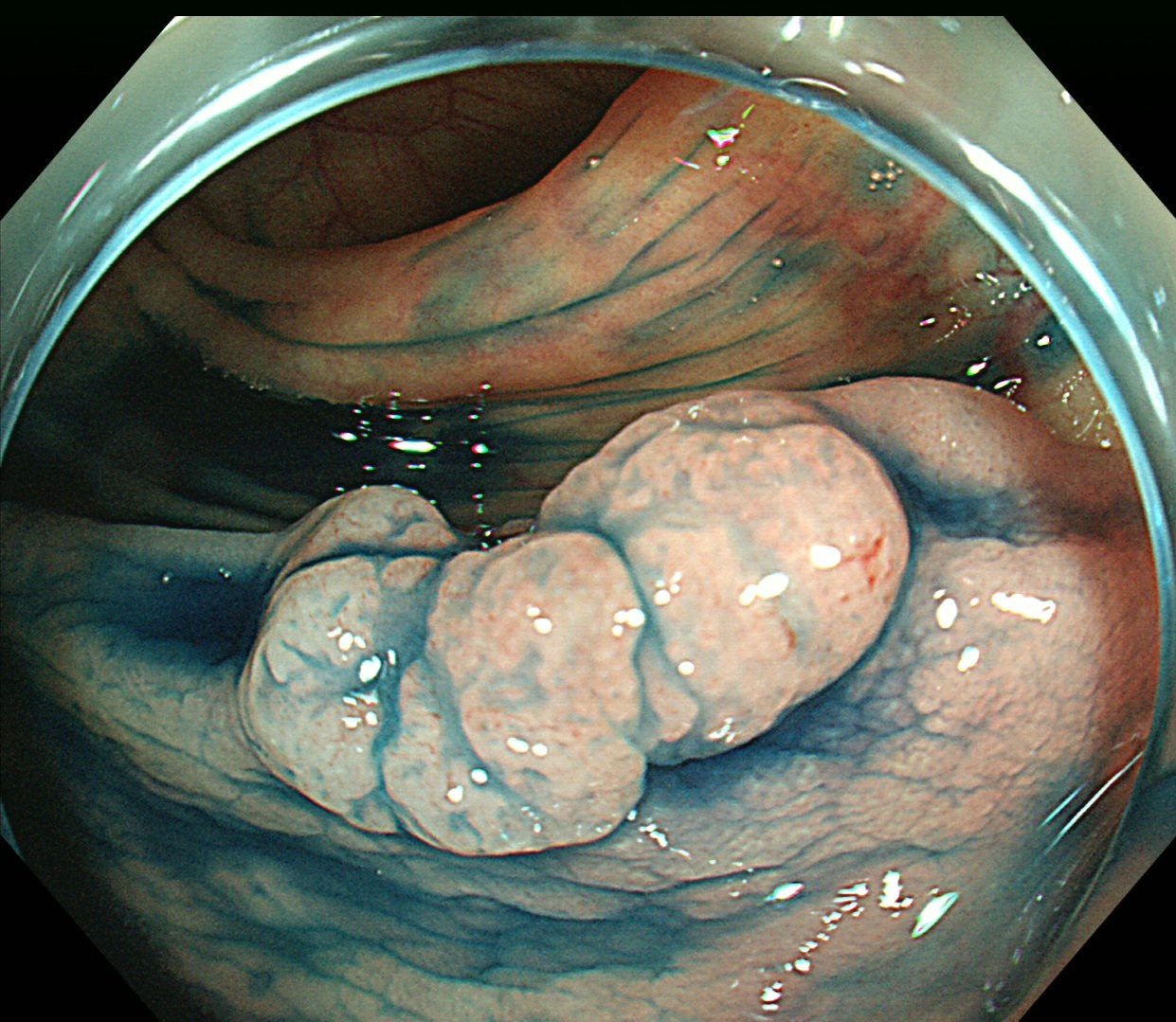
インジゴカルミンを使用した色素内視鏡検査像
③ 画像強調観察検査
画像強調観察検査とは、NBI(Narrow Band Imaging)を使った特殊な波長の光で大腸ポリープの表面を観察する検査のことを言います。
このNBI観察を行うことで、大腸ポリープの表面の血管や構造を観察することができます。ただしNBIだけだと詳細な観察はできないため、拡大内視鏡検査を併用(NBI拡大内視鏡検査)して下記の2つを詳しく観察します。
- 微小血管(vessel pattern)
- 表面構造(surface pattern)
今までは形や構造などを見ることで主に診断していましたが、NBI拡大内視鏡検査行うことで細かな血管で大腸ポリープのがんの診断が可能となりました。NBI拡大内視鏡検査による診断分類としては、JNET大腸拡大NBI分類というものが使用されています。
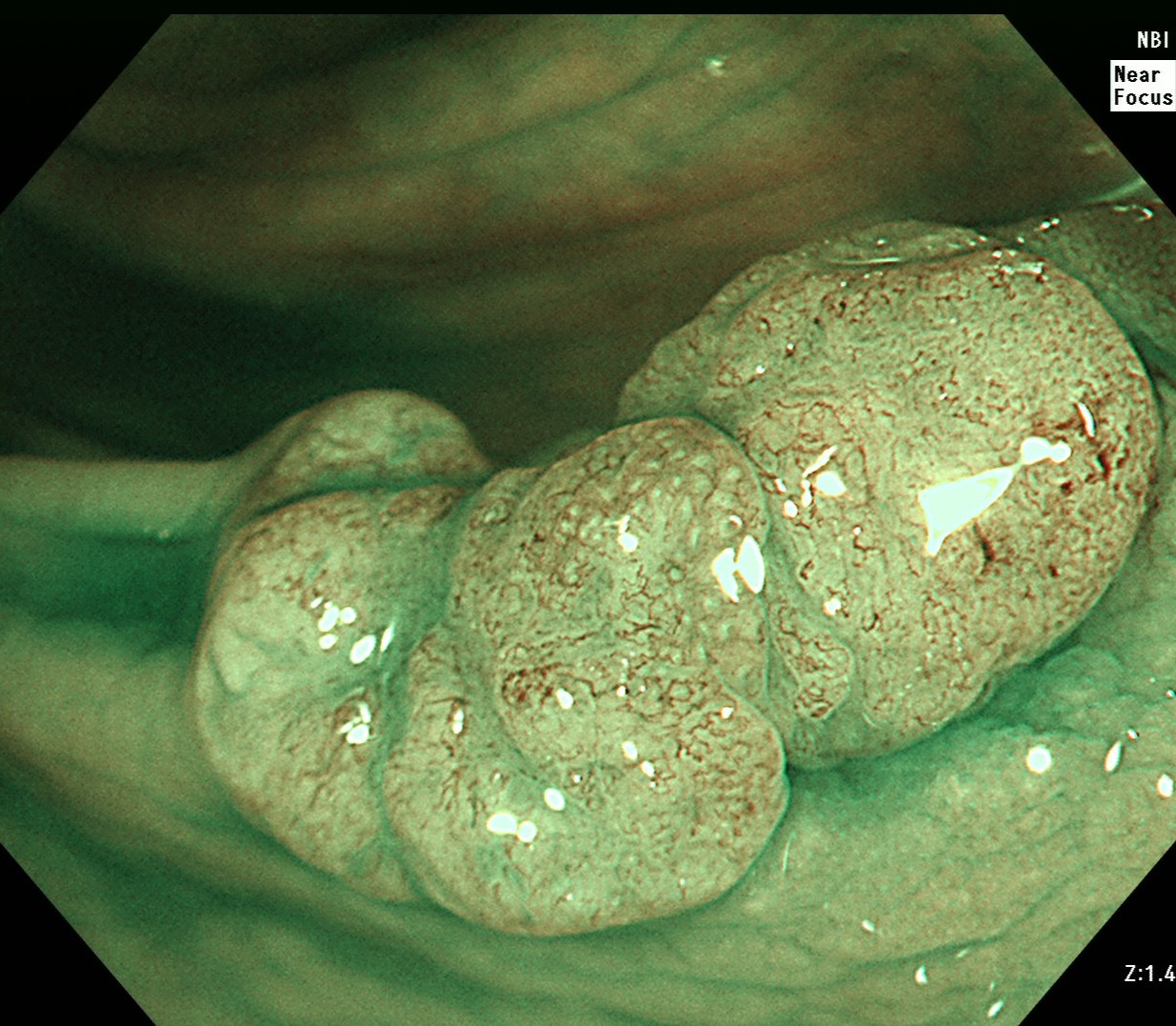
NBIを使用した内視鏡観察像
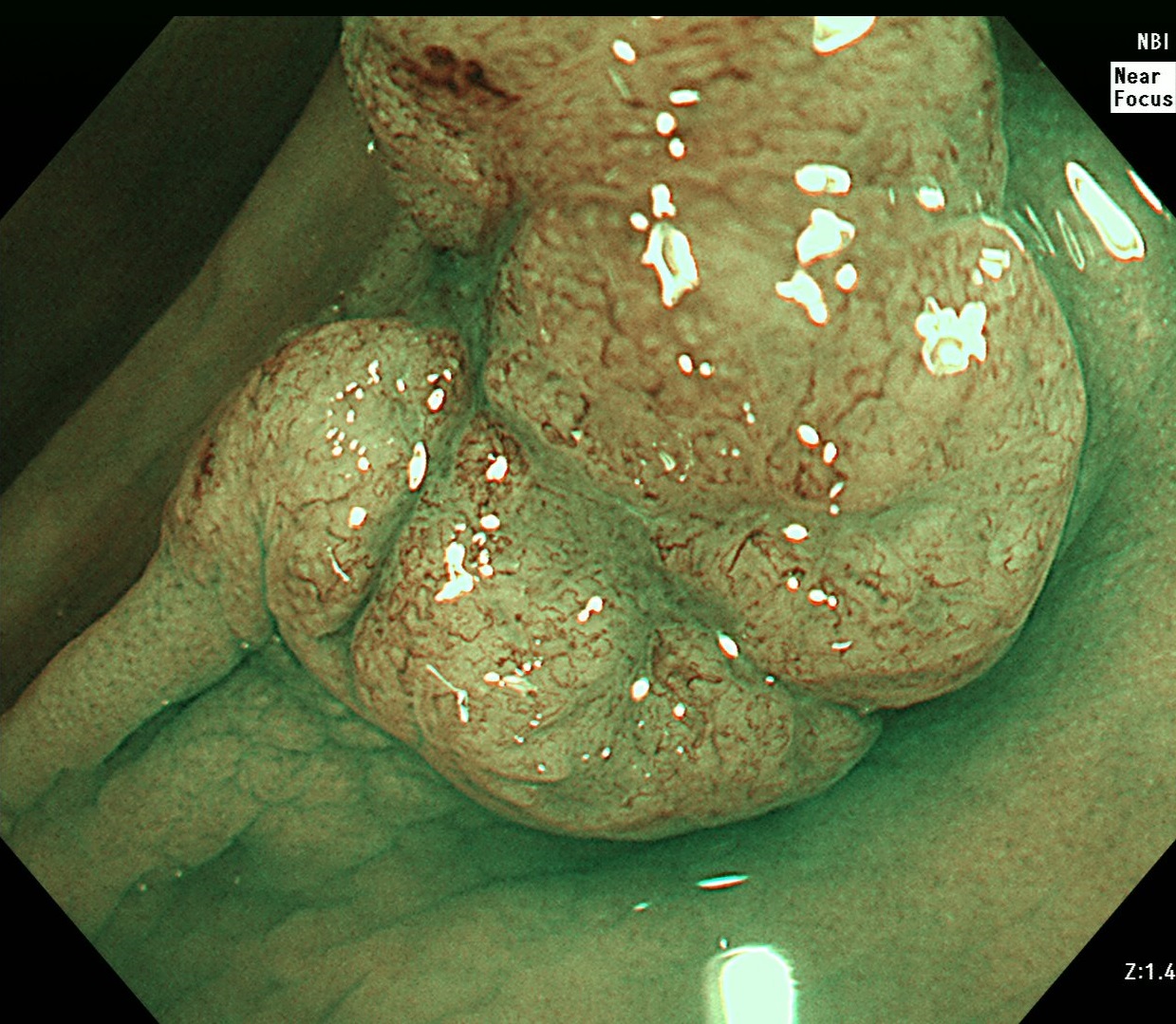
NBI拡大内視鏡像
④ 超音波内視鏡検査
超音波内視鏡検査は、EUS(Endoscopi ultrasonography)とも言い、大腸ポリープががんであった場合の深達度診断に役立ちます。
とくに大腸ポリープががんへと進行していた場合にどのくらい進行しているのかリンパ節への転移はあるのかなどの検査を行う場合にEUSを行うことがあります。
ただしほとんどの場合には、①~③の検査で深達度やリンパ節転移のリスクなどの評価は行えることが多いため、診断に迷う場合などで行われることが多い検査です。
大腸ポリープの切除方法
大腸ポリープの切除方法には、「ホット」と「コールド」の2つがあります。
切除方法は以下の2つが主なものです。
- ① HSP(Hot Snare Polypectomy; ホット・スネアー・ポリペクトミー)
- ② CSP(Cold Snare Polypectomy; コールド・スネアー・ポリペクトミー)
① HSP
HSPは、従来から施行されていた大腸ポリープの切除方法で、高周波と呼ばれる電流を流す装置を用いてスネアーという金属製の輪っかで大腸ポリープを焼き取ってしまう方法です。
古くから行われていた治療方法のため多くの施設で安定的に行われている方法です。
② CSP
CSPとは、HSPで使用されている高周波を使用しないで大腸ポリープを切除する方法です。細く切れ味の良いスネアーを用いて、大腸ポリープを物理的にギュッと一気に切除してしまう方法です。一時的に出血はしますが、すぐに止まるのがCSPの特徴です。
CSPは、イタリアのTapperoが1992年に報告したのが始まりですが、2010年代になって選択される治療法の一つとなってきました。近年では、10mm以下の小さなポリープに関しては、ほとんどがCSPでの大腸ポリープ切除が一般的となってきています。
大きな大腸ポリープや根元に茎があり太い血管が存在することが予想される場合にはHSPで切除を行うことがあります。
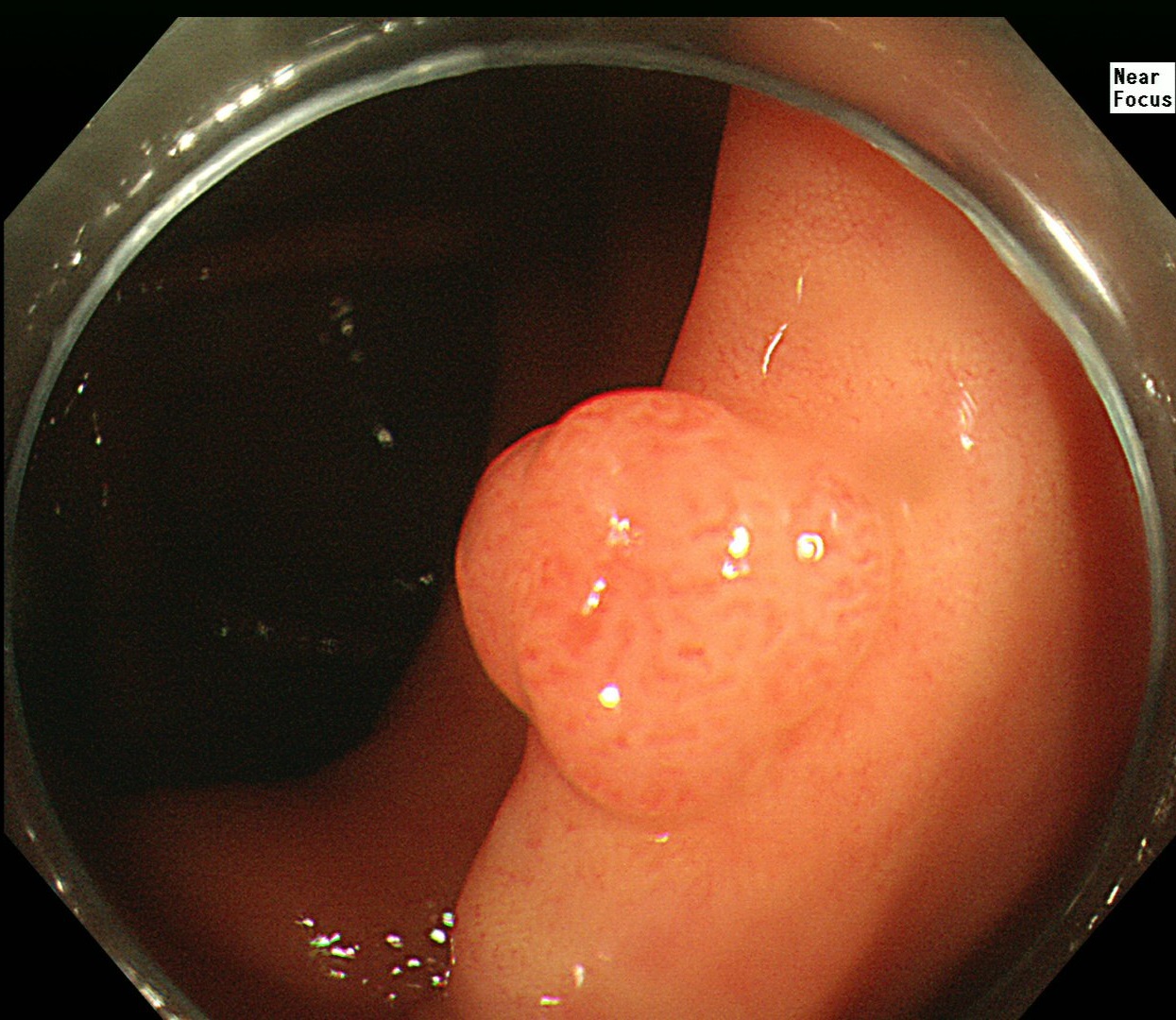
大腸ポリープ像
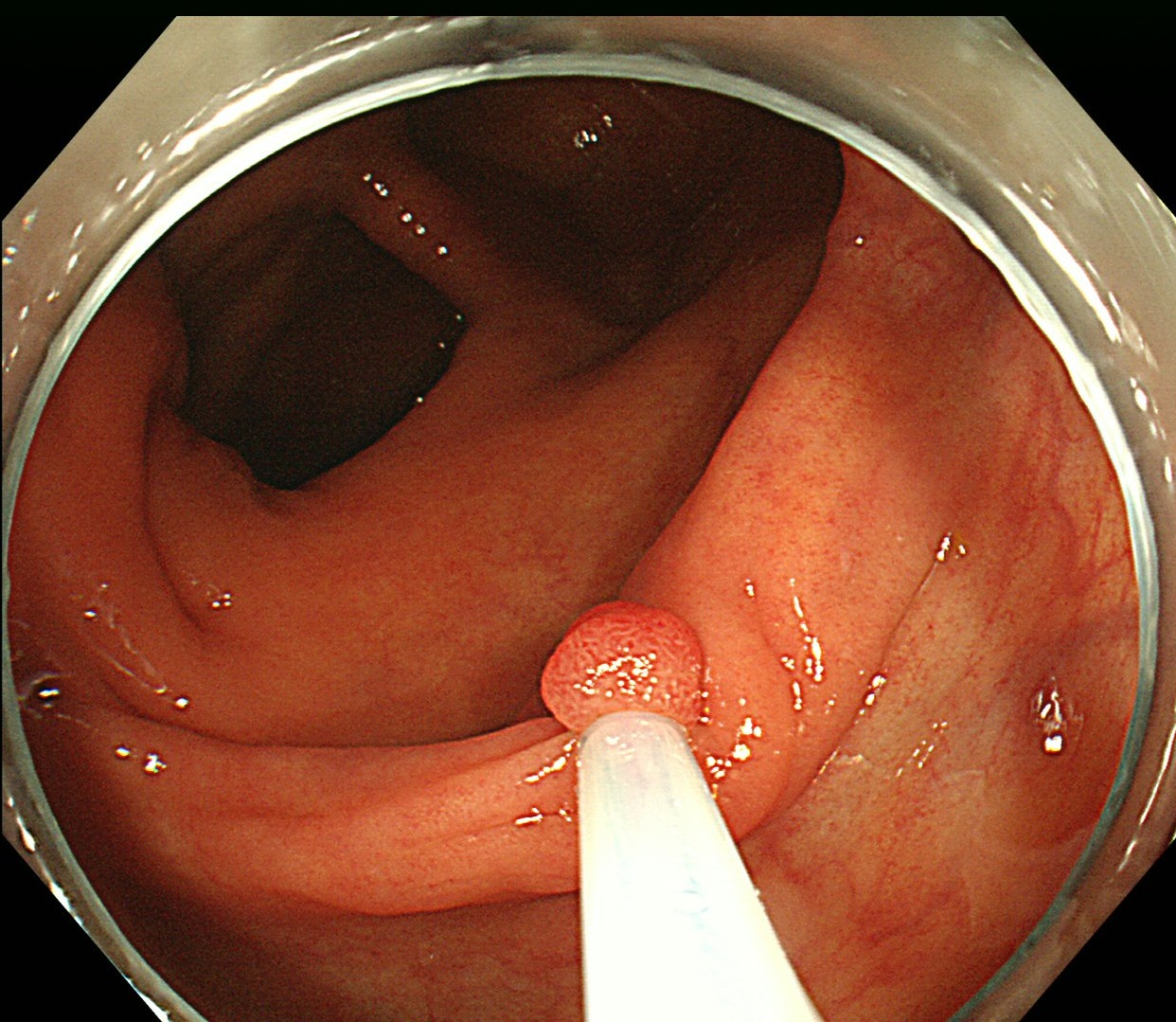
CSPのスネアリング像
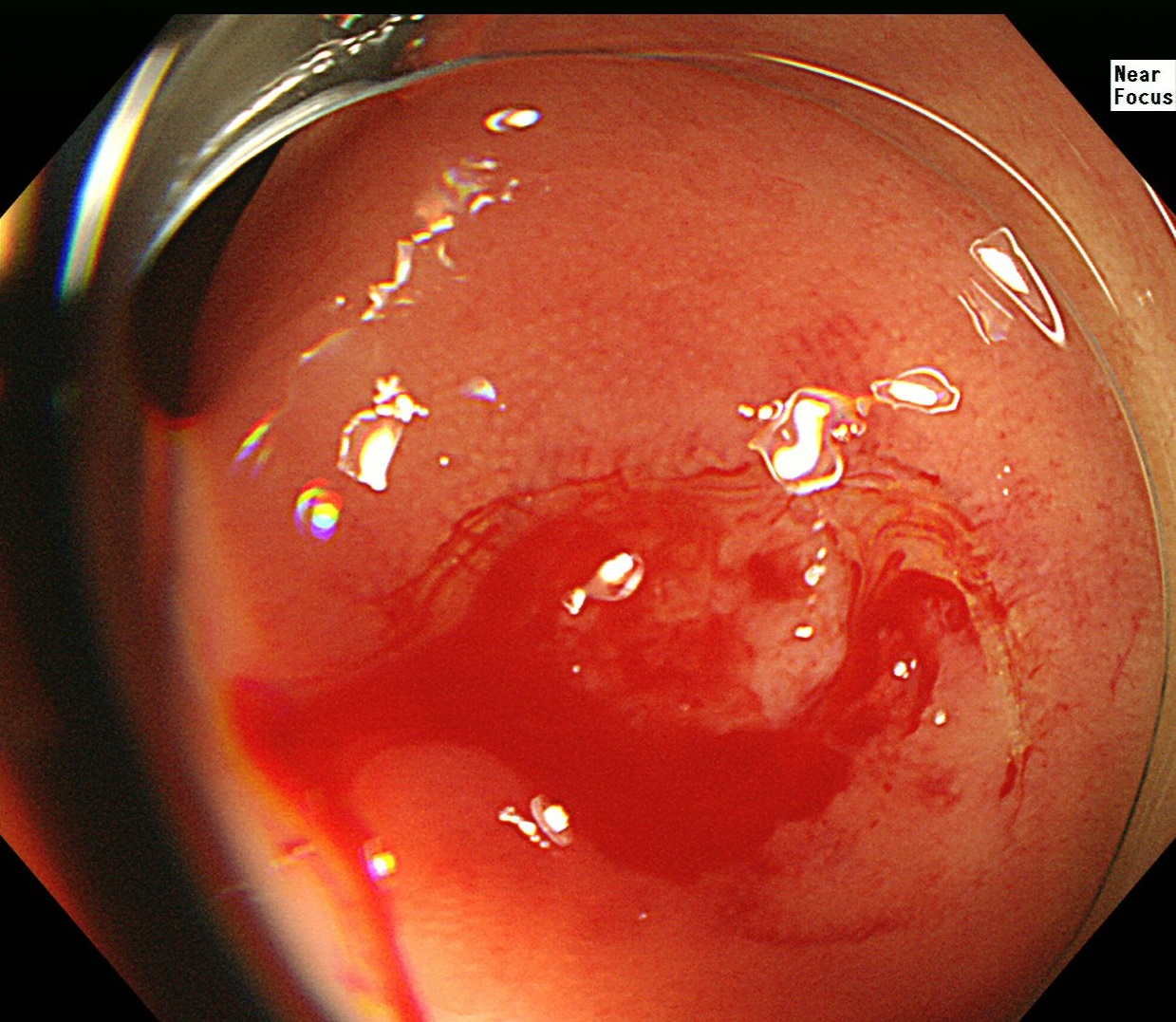
CSPによる切除後像
大腸ポリープ切除の費用については下記ブログ記事を参考にしてください。
通常のポリペクトミーで切除できない場合は
大腸ポリープの大きさや種類によっては、通常のポリペクトミーでは切除できないことがある
通常のポリペクトミーで切除が難しいケース
HSPやCSPでは切除が難しい大腸ポリープがあります。どのような要因で切除が難しいかというと下記のような要因があげられます。
- 大きい大腸ポリープ
- 扁平型(平べったい)もの
- 繊維化の強いもの
上記のような場合には、通常のスネアーという金属製の輪っかでは切除が難しいことがあります。大きい大腸ポリープの場合には、スネアーを引っかけることができません。また、扁平型もスネアーを引っかけることが難しいことが多いです。大腸ポリープの部位の壁の部分(粘膜下層)に繊維化といって硬くなっている場合にも、スネアーで焼き切ることが難しいこともあります。
上記のようなHSPやCSPでの治療が難しい場合には、下記のような治療方法で大腸ポリープを切除します。
特殊な切除方法(EMR・ESDなど)
- ① EMR
- ② ESD
- ③ Underwater EMR
- ④ Underwater ESD
- ⑤ Waterpocket ESD
20mm以上の平べったい大腸ポリープやがん化をしている大腸ポリープの場合には上記のような治療法で切除することが望まれます。
分割切除のリスクと一括切除の重要性
大腸ポリープのサイズが大きくがん化している場合に、通常のHSPやCSPで切除した場合には病変を一括(病変を一つのものとして)で切除することが難しいと考えられています。一括で切除できない場合には、分割と言って病変をいくつかに分けて切除されることがあります。
この分割での切除(分割切除)の場合には、再発するリスクが高くなると言われています(15%くらいの再発率になると報告されている)。そのため病変を一括で切除することが大切であると私たち内視鏡医は考えています。一括で切除することで、ほとんど再発することはないと考えられています。当クリニックでは、①~⑤の治療方法から一人一人の患者様に適したものを選択して治療を行っています。
ESD治療やWaterpocket ESDについては
下記をご参考にしてください。
大腸ポリープ切除の合併症は
大腸ポリープ切除の合併症には、主に出血と穿孔の2つがあります
大腸ポリープ切除の合併症としては下記のようなものが挙げられます。
- ① 術中出血
- ② 遅発性出血
- ③ 術中穿孔
- ④ 遅発性穿孔
上記のように大腸ポリープを切除している術中に起こるものと、治療が終わっていくらか経過した後に起こる合併症があります。術中で起こるものは、その場で対処できることが多いためさほど大事にはなりません。
問題は、術後ある程度経過してから起こる遅発性の出血や穿孔です。遅発性の合併症が起こった場合には、入院や手術が必要なこともあるため注意が必要です。
① 術中出血
術中出血とは、大腸ポリープを切除した時に切除部位より60秒以上持続して続く出血のことを言います。このような場合には、内視鏡スコープを用いて圧迫止血やクリップを使用した止血術が必要となります。
② 遅発性出血
遅発性の出血は、大腸ポリープを切除して帰宅されてから30日以内に起こる出血のことを言います。排便時に血便として見られ、救急搬送や入院が必要となることがあります。出血が明らかな場合には、再度大腸カメラを行い止血術を行います。遅発性出血はHSPの方が多いと報告されており、CSPでの切除が主流となってきています。
③ 術中穿孔
術中穿孔とは、大腸ポリープを切除した際に大腸の壁に穴が開いてしまう合併症です。非常に稀な合併症ですが、穴が開いてしまった場合にはその場でクリップを用いて穴を塞ぎます。
④ 遅発性穿孔
遅発性穿孔とは、大腸ポリープを切除して帰宅されてから起こる穿孔です。お腹の痛みや発熱などの症状が生じることが多いです。
穿孔してしまった部位を内視鏡的にクリップで閉じることもできますが、外科手術になってしまうこともあります。従来のHSPでの治療が主流であった時代には、電流の熱がこもることで時間が少したってから先行することもありましたが、現在ではCSPが主流となっているため遅発性の穿孔はほとんど見られなくなっています。
大腸ポリープを切除した後は
大腸ポリープを切除した後は、1週間ほど食事や日常生活に気を付けて過ごす
大腸ポリープを切除した場合には、上記のような合併症が起こる可能性があるため最低1週間は食事・日常生活に気を付けて過ごす必要があります。
大腸ポリープ切除後に気をつける生活習慣
どのような点に気を付けるかというと、
- 食事に気をつける(辛い物・脂っこい物・消化の悪い物を避ける)
- 食べ過ぎない
- アルコールを避ける
- 運動を控える
- 飛行機での移動を避ける
- 湯船に入らずにシャワーを使用する
などに気を付ける必要があります。
検査の詳細についてのご相談は、直接外来診察にてご相談ください。
大腸カメラの予約方法
当クリニックでは以下の方法で
大腸カメラ検査の予約が可能です。
ご希望の方は、
WEBまたはお電話でご予約ください。
<参考文献>
・Bretthauer M, Loberg M, Wieszczy P. et al. Effect of colonoscopy screening on risks of colorectal cancer and related death. NEJM 2022; 387: 1547-1556
・Ferlitsch M, Moss A, Hassan C. et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2017; 49: 270-297
・Bianco MA, Cipolletta L, Rotondano G. et al. Prevalence of nonpolypoid colorectal neoplasia: an Italian multicenter observational study. Endoscopy 2010; 42: 279-285
・Burgess NG, Hourigan LF, Zanati SA. et al. Risk stratification for covert invasive cancer among patients referred for colonic endoscopic mucosal resection: a large multicenter cohort. Gastroenterology 2017; 153: 732-742
・van Doorn SC, Hazewinkel Y, East JE. et al. Polyp morphology: an interobserver evaluation for the Paris classification among international experts. Am J Gastroenterol 2015; 110: 180-187
・Uno Y, Munakata A. The non-lifting sign of invasive colon cancer. Gastrointest Endosc 1994; 40: 485-489
・Harada H, Miyaoka Y, Yuki T, et al. Postpolypectomy bleeding of colorectal polyps in patients with continuous warfarin and short-term interruption of direct oral anticoagulants. Gastrointest Endosc. 2021;93(3):691-698
・山際裕史, 大西徹哉, 大腸腺腫の癌化―最近5年間のポリペクトミー例. 治療1994; 76: 2879-2882
・山野泰穂, 黒田浩平, 吉川健二郎, ほか. 大腸腫瘍性病変の臨床病理学的特性からみた内視鏡治療の適応と実際―スネアEMRの観点から. 胃と腸 2007; 42: 1053-1059
・Sano Y, Tanaka S, Kudo SE, et al. Narrow-band imaging (NBI) magnifying endoscopic classification of colorectal tumors proposed by the Japan NBI Expert Team. Dig Endosc. 2016;28(5):526-533






